На участке производства стерильных лекарственных средств была проведена валидация процесса формирования серии лекарственного препарата из технологических загрузок, наработанных в течение 4 дней в соответствие с Промышленным регламентом. Процесс очистки формирования серии лекарственного препарата из технологических загрузок, наработанных в течение 4 дней обеспечивают однородность серии лекарственного препарата в рамках требований нормативного документа и гарантирует ее качество. При оценки потенциальных рисков использовался метод FMEA. Метод анализа видов и последствий несоответствий.
Рассмотрим порядок работы по управлению рискам методом FMEA. К основным этапам относятся:
1) формирование группы по оценке рисков:
– ознакомление с проектом (задачей), сбор исходных данных для проведения анализа рисков по FMEA, определение границ системы/объекта (например, диаграмма Исикавы);
– оценка влияния системы/объекта на качество
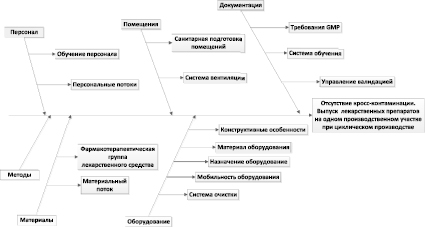
2) анализ риска (определение сценариев и причин риска для критичности компонентов системы/подсистемы, оценка рисков) в том числе:
– выявление всех возможных потенциальных опасностей (несоответствий);
– составление списка возможных последствий (S) для каждого несоответствия; каждое последствие, в соответствии с его серьезностью, оценивается по 5-балльной шкале, при этом балл 5 соответствует наиболее тяжелым последствиям;
– оценка вероятности возникновения причины несоответствия (O); каждая выявленная причина несоответствия, в соответствии с ее вероятностью возникновения, оценивается экспертами по 5-балльной шкале, при этом балл 5 соответствует наиболее часто встречающимся причинам;
– оценка вероятности обнаружения причины несоответствия (D), оценивается по 5-балльной шкале, при этом балл 5 соответствует почти никогда не обнаруживаемым причинам несоответствия;
– вычисление приоритетного числа риска (ПЧР) для каждого последствия;
– выбор несоответствий, над которыми предстоит работать;
– разработка корректирующих мер для устранения или сокращения несоответствий с высоким показателем риска.
3) документальное оформление анализа рисков;
4) переоценка степени риска с учетом проведенных САРА (корректирующих и предупреждающих действий).
На представленной диаграмме рассмотрены основные направления, в которых могут возникнуть риски для качества при производстве лекарственных препаратов.
Библиографическая ссылка
Татарникова А.А., Дворянинова О.П., Клейменова Л.Н. ОЦЕНКА ПОТЕНЦИАЛЬНЫХ РИСКОВ ПРИ ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ // Материалы МСНК "Студенческий научный форум 2025". 2020. № 2. С. 74-75;URL: https://publish2020.scienceforum.ru/ru/article/view?id=98 (дата обращения: 22.01.2026).

