Данный литературный обзор направлен на раскрытие вопросов о современном состоянии проблемы инфицирования при эндопротезировании крупных суставов.
Инфекции в области хирургического вмешательства продолжают оставаться серьезным, потенциально опасным для жизни осложнением операции. Социальное бремя этих инфекций огромно. Инфекции будут присутствовать всегда и не могут быть полностью устранены. Новые технологии, связывающие профилактические противомикробные препараты с имплантатами, показали многообещающие результаты, а также более простые методы, такие как нагруженный антибиотиками костный цемент в случаях артропластики и прямое введение антибиотиков в саму рану.
Перипротезная инфекция является одним из наиболее тяжелых осложнений в эндопротезировании. И хотя частота инфекционных осложнений составляет около 1 % при операциях на тазобедренном суставе и около 2 % при операциях на коленном суставе, лечение этой категории пациентов – процесс сложный и очень дорогой. Ранняя диагностика и своевременное лечение инфекционных осложнений дают возможность сохранить эндопротез и значительно снизить стоимость лечения [1].
Таблица 1
Факторы риска развития осложнений при эндопротезировании [6]
|
Модифицируемые факторы риска |
Немодифицируемые |
|
|
Фактор |
Модификация |
Фактор |
|
Ожирение |
Снижение веса |
Пожилой возраст |
|
Курение |
Отказ от курения |
Онкология |
|
Диабет |
HbA1C<7-8 % |
Ревматоидный артрит |
|
Наркомания |
Отказ от наркотиков |
Болезни печени |
|
Потребление алкоголя >4 единиц в сутки |
Отказ от алкоголя |
Почечная недостаточность |
|
Иммуносуппресивные препараты |
Отказ от определенных лекарственных средств перед операцией |
Серповидноклеточная анемия |
|
Анемия |
Препараты железа, эритропоэтин |
Гепатит С |
|
Недоедание |
Диета богатая белком |
ВИЧ |
|
Носители Staphylococcus aureus |
Деколонизация пациента |
Мужской пол |
|
Псориаз |
||
|
Сердечно-легочные заболевания |
Основной причиной острого послеоперационного и гематогенного инфицирования суставов является изолированная грамположительная микрофлора, которая наблюдается более чем в 50 % случаев. Наличие необратимой формы биопленки на поверхности удаленных элементов эндопротеза у всех пациентов со сроками манифестации перипротезной инфекции более 2 недель объясняется высоким уровенем рецидива гнойного процесса, который достигает 33,3 % после дебридмента коленного и 45 % после дебридмента тазобедренного сустава [2].
Увеличение числа больных с патологией крупных суставов является проблемой современной цивилизации и обусловлено старением населения планеты. В прямой связи с прогрессирующим развитием медицинских технологий значительно расширились показания к этим операциям [3].
Растущее число осложнений и неудач повлекли за собой появление новой операции, еще более масштабной по своим характеристикам – это хирургическая ревизия сустава после эндопротезирования. В связи с ростом числа эндопротезирований суставов становится актуальной проблема профилактики и лечения инфекционных осложнений [3].
Развитие перипротезной инфекции (ППИ) после первичного эндопротезирования тазобедренного сустава влечет за собой тяжелые хирургические и социально-экономические проблемы. Наряду с совершенствованием технического обеспечения артропластики и схем антибиотикопрофилактики ключевым моментом в снижении частоты инфекционных осложнений является прогнозирование ее развития у конкретного пациента [5].
Как и в случае любого инфекционного заболевания, факторы хозяина играют определяющую роль в патогенезе.Инфекция вокруг протеза может возникнуть, когда инфекционные организмы найдут доступ к имплантату. Во время эпизода бактериемии способность хозяина избавляться от патогенов, передающихся с кровью, зависит от иммунной системы пациента. Таким образом, любые иммунодефицитные состояния, такие как рак, диабет, вирус иммунодефицита человека и воспалительные артропатии, подвергают пациента более высокому риску развития ППИ. Другие модифицируемые факторы риска, такие как ожирение, которое определяется как индекс массы тела> 35 кг / м2, чрезмерное употребление алкоголя, тяжелое курение и внутривенное употребление наркотиков, также были связаны с повышенным риском ППИ. Некоторые немодифицируемые факторы риска ППИ включают пожилой возраст и мужской пол. Пациенты с другими сопутствующими заболеваниями, такими как сопутствующие сердечно-легочные заболевания, депрессия, гемофилия, гепатит С, недоедание, артериальная гипертензия, почечная недостаточность, заболевание печени, серповидно-клеточная гемоглобинопатия и псориаз, также имеют более высокий риск инфицирования. Наконец, история недавних или отдаленных инфекций, таких как предыдущие инфекции в том же суставе , перенесенные ортопедические инфекции , колонизация метициллин-резистентным золотистым стафилококком (MRSA) и инфекции мочевыводящих путей может предрасполагать пациентов к развитию околопротезной суставной инфекции [8].
Простая классификация, основанная на клинических проявлениях, позволяет дифференцировать раннее начало PJI (если менее 3 месяцев после операции), обычно инициируемое во время операции в результате интраоперационного заражения относительно вирулентными микроорганизмами; отложенное начало ППИ (через 3 месяца, но до 12–24 месяцев после операции) менее вирулентными микроорганизмами, но с тем же происхождением во время операции; и позднее начало ППИ (более 12–24 месяцев после операции), часто из-за гематогенной инфекции, но иногда из-за очень низкосортных микроорганизмов с крайне вялотекущей инфекцией, инициированной во время операции [11].
Таблица 2
Классификация Перипротезной суставной инфекции [4]
|
Типы инфицирования |
Острая инфекция |
Хроническая инфекция |
|
Периоперационное происхождение |
• Ранний послеоперационный период • <4 недель после операции |
• Поздний послеоперационный • >4 недель после хирургии |
|
Гематогенное происхождение |
<3 недель симптоматики |
>3 недель симптоматики |
|
Зрелость биопленки |
Незрелая |
Зрелая |
|
Клиника |
Острая суставная боль,лихорадка,отек и покраснение сустава |
Хроническая суставная боль,нестабильность протеза,фистула |
|
Микроорганизмы |
Высоковирулентные : St.aureus, гр(-) бактерии (н-р, E.coli,Klebsiella spp.,Pseudomonas aeruginosa0 |
Слабовирулентные: Коагулозо-негативные стафилококки (н-р,St.epidermidis) Propionibacterium acnes |
|
Хирургическое лечение |
Дебридмент Стабилизация протеза |
Полное удаление протеза (в один или несколько этапов) |
С практической точки зрения для диагностики параэндопротезной инфекции наиболее рациональным представляется использование классификация Coventry M.B.-Fitzgerald R.H. (1975) с дополнением D.T. Tsukayama (1996), основой которой является временной интервал от момента эндопротезирования до манифестации инфекционного процесса. Согласно этой классификации выделены 4 основных типа инфекционных осложнений (ИО), имеющие свои временные и клинические характеристики и требующие различных тактических подходов к хирургическому лечению [3].
I тип ИО – быстроразвивающаяся послеоперационная инфекция (в том числе инфицированная гематома, поверхностная инфекция, прогрессирующая в глубокую инфекцию) в течение первых 3-х месяцев (преимущественно 1-го месяца) от операции.
II тип ИО – постепенное развитие инфекционного процесса с манифестацией в сроки от 3 месяцев до 1 года после эндопротезирования.
III тип ИО – острая поздняя гематогенная инфекция, развивающаяся быстро в ранее нормально функционирующем протезированном суставе, характеризуется поздним началом (обычно не менее 2-х лет) от эндопротезирования, гематогенным происхождением.
IV тип ИО – без клинических проявлений обнаружение положительных интраоперационных 2 посевов с изоляцией одного и того же инфекта.
Некоторые имплантаты могут быть колонизированы бактериями, живущими в биопленке, при этом бактерии не проявляются клинически. Доля таких бессимптомно колонизированных устройств неизвестна и во многом зависит от используемого диагностического метода. Результаты высокочувствительных диагностических методов, таких как обработка ультразвуком, ПЦР или более новые молекулярные методы, трудно интерпретировать, и необходимы дальнейшие долгосрочные исследования, чтобы отличить загрязнение во время обработки образца от колонизации на реальном устройстве. Также неясно, становится ли всякая бессимптомная колонизация в какой-то момент клинически очевидной как инфекция. Некоторые колонизированные имплантаты могут оставаться бессимптомными в течение длительного времени, когда хозяин постоянно подавляет биопленочные микроорганизмы. Также неясно, что запускает бессимптомные бактерии биопленки, чтобы начать отслоение, репликацию и возникновение клинической инфекции [7].
Пациенты подвергаются повышенному риску ППИ (перипротезной инфекции) при наличии инфекции или воспалительного процесса в другой части тела, например, инфекциях мочеполовой системы, дыхательных путей, сердца, желудочно-кишечного тракта, кожи и кровотока. Недавнее использование антибиотиков часто указывает на потенциальный инфекционный агент, который может заразить сустав и привести к инфицированной пластике сустава. Пациентов следует спросить о симптомах инфекции мочевыводящих путей, таких как позывы к мочеиспусканию, дизурия, частое мочеиспускание или задержка мочи. Пациентов также следует спрашивать о респираторных симптомах, таких как кашель, одышка и выделение мокроты, которые могут указывать на верхние дыхательные пути как на источник возможного ППИ. Эндокардит может быть сердечным источником инфекции , тогда как холангит и холецистит из желудочно-кишечного тракта также могут заразить протезный сустав. Наконец, инфекции в других частях тела, таких как ротовая полость и толстый кишечник, могут содержать абсцессы, которые приводят к бактериемии и потенциальному заражению протезных суставов. Сообщалось, что стафилококковая бактериемия имеет 30 % риск развития ППИ [6].
Инвазивные процедуры, выполняемые на теле, также могут высвобождать бактерии в кровоток и предрасполагать пациентов с протезами суставов к инфицированию. Инвазивные стоматологические процедуры, такие как дренирование периапикального абсцесса, могут привести к высвобождению из полости рта бактерий, таких как Treponema denticola, Actinomyces israelii, Actinomyces naeslundii, Streptococcus viridans и Streptococcus oralis. Желудочно-кишечные процедуры, такие как колоноскопия и эндоскопия, могут привести к высвобождению грамотрицательных организмов, таких как Escherichia coli и Klebsiella pneumoniae [12]. Кроме того, любая недавняя хирургическая процедура, при которой повреждена кожа, может увеличить количество комменсальных организмов, таких как St.aureus и Staphylococcus epidermidis [13]. Опрос пациентов о недавнем медицинском анамнезе может помочь в целевых исследованиях по изоляции конкретных организмов, происходящих из этих источников.
Наиболее распространенными микроорганизмами, связанными с инфекцией протезов коленного сустава, являются S. aureus (27 %), за которыми следуют S. epidermidis (16 %), Proteus mirabilis и S. agalactiae (по 5 % каждый), P. aeruginosa, Streptococcus mitis, Enterococcus faecalis, Citrobacter видов и Candida albicans (по 2 %). О грамотрицательных палочках все чаще сообщается при инфекциях протезов коленного сустава [9].
Наиболее частыми возбудителями инфекции протеза тазобедренного сустава являются S. aureus и коагулазонегативные стафилококки, за которыми следуют смешанная флора, стрептококки, грамотрицательные палочки, энтерококки и анаэробные бактерии [9]. Риск инфицирования при ортопедических процедурах, требующих хирургического вмешательства или установки оборудования, колеблется в пределах 3-6 %. Риск возрастает при увеличении времени операции, а также при наличии множества разрезов и операционных участков. Артропластики подвержены повышенному риску инфицирования. Симптомы обычно возникают до появления рентгенологических изменений. Если есть рентгенологические отклонения, они включают выпот, серпигинозное разрушение костной ткани, периостальную реакцию и реакцию внутрикостной кости. Редко в мягких тканях виден воздух. Пушистое, незрелое околосуставное гетеротопическое образование кости может указывать на диагноз. Однако в большинстве случаев рентгенограмма кажется нормальной; Если есть клиническое подозрение на инфицированное эндопротезирование, следует выполнить аспирацию.МРТ может быть полезно при диагностике образования свищей или абсцесса [10].
Диагностика
Общий диагноз требует оценки того, инфицирован ли сустав, и, если да, определения причинных микроорганизмов и их чувствительности к антимикробным препаратам. Таким образом, диагноз околопротезной инфекции является результатом комбинации клинических данных, рентгенологических результатов (включая ранний остеолиз и внутрикостные абсцессы), лабораторных результатов (в частности, С-реактивный белок,лейкоцитарная формула, IL-6 и прокальцитонин) из периферической крови и синовиальной жидкости, микробиологических данных, интраоперационного осмотра и гистологической оценки перипротезной ткани. Ни один тест сам по себе не обеспечивает достаточной точности. Клинически окончательные доказательства перипротезной инфекции сустава получают только тогда, когда подтверждается связь синусового тракта с протезом или идентичный патоген, обнаруженный в двух отдельных образцах перипротезной ткани или жидкости. Другие второстепенные критерии также предоставляют подтверждающие (хотя и не окончательные) доказательства, такие как гнойность вокруг протеза, острое воспаление в перипротезной гистологии, единичный вирулентный организм, повышенный уровень лейкоцитов, СРБ и СОЭ [11].
Всем пациентам с тотальной артропластикой следует сделать простой рентгеновский снимок подозреваемого сустава, так как рентгеновские снимки у пациента с парапротезной инфекцией могут быть нормальными или демонстрировать рост надкостницы, транскортикальные ходы синуса или расшатывание. Компьютерная томография (КТ) и магнитно-резонансная томография имеют ограниченное применение из-за рассеяния от имплантата, но могут использоваться для оценки мягких тканей с такими результатами, как скопления перипротезной жидкости иабсцессы.
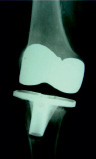
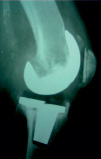
Рис. 1. Инфекция перипротезного сустава
Септическое расшатывание большеберцовой ножки в этом случае. Через 3 года после тотального эндопотезирования коленного сустава, связанного с иммунодепрессией из-за химиотерапии при лечении тяжелых злокачественных новообразований на (а) переднезадних и (б) боковых рентгенографических снимках [11].
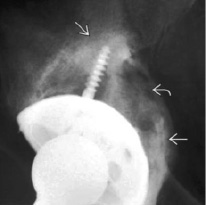
Рис. 2. Рентгенограмма тазобедренного сустава в переднезадней проекции
Несимметричный просвет вокруг кончика бедренного протеза. Это признаки инфицирования после тотальной артропластики бедра. Несмотря на то, что их постоянно ищут, признаки заражения редко бывают настолько очевидными [10].
Лечение
Лечение перипротезной инфекции сустава обычно требует как хирургического вмешательства, так и медикаментозного лечения, включая длительную антибактериальную терапию после выписки из больницы. Строго требуется командный подход, включающий хирургов, микробиологов, врачей-инфекционистов, медперсонал и других специалистов здравоохранения. Варианты хирургического лечения варьируются от санации раны с удержанием протеза (при ранних инфекциях, особенно гематогенного происхождения), одноэтапной замены артропластики, двухэтапной замены артропластики с или без антибиотиконаполненного полиметилметакрилатного спейсера, артропластической резекции без повторной имплантации или даже подавляющего лечения, состоящего из длительного лечения только антибиотиками. В редких случаях может потребоваться ампутация в случае жизненного риска для пациента.Но помимо комплексного междисциплинарного лечения этих инфекций, периоперационная и послеоперационная профилактика является важным аспектом контроля этих тяжелых состояний [11].
В связи с отсутствием эффективных антибиотиков для системного применения , неоперативное лечение в основном основывается на симптоматическом лечении (например, противовоспалительные препараты, анальгетики, ортопедические корсеты) и на супрессивной антибактериальной терапии. Подавляющая антибиотикотерапия определяется как длительное применение пероральных антибиотиков для предотвращения рецидивов симптомов и функциональной недостаточности у пациентов с ретенцией имплантата.
Нехирургическое лечение, как правило, предназначено для пациентов с безболезненным септическим протезом, вызванным микроорганизмами, чувствительными к пероральным антибиотикам. В частности, супрессивное лечение антибиотиками может быть показано пациентам, у которых присутствует одно или несколько из следующих [14]:
– Отказ от хирургического лечения
– Не поддается хирургическому лечению из-за высокой хирургической
риск из-за сопутствующих заболеваний
– Есть инфекция, которая не была ликвидирована после
предыдущее хирургическое лечение (я) в соответствии с клиническими данными,
лабораторные данные или данные изображений
– Безболезненные и хорошо интегрированные инфицированные имплантаты,
при которых можно предвидеть повышенную инвалидность и / или большой дефект кости вследствие удаления протеза.
Нет четких доказательств того, что одна схема приема антибиотиков эффективнее другой [15], и многие рекомендации в значительной степени основаны на эмпирических решениях. Обычно рекомендуется идентификация микроорганизма и выбор антибактериальной терапии на основе профиля чувствительности изолированного патогена, предпочтительно полученного из глубоких проб путем аспирации суставов или хирургической обработки раны. Принимая во внимание низкую вероятность искоренения инфекции и ограниченность имеющихся научных данных, лечение антибиотиками можно разделить на два этапа:
1. Индукция к ремиссии
2. Хроническое подавление
Дебридмент и стабилизация импланта
Санация и удержание имплантата, также известные как ирригация и санация, направлена на сохранение уже имплантированного протеза, лечение пациента хирургической очисткой протеза, с изменением модульных частей имплантата или без него, а также санация окружающих тканей с последующей лечение антибиотиками.Существует общее мнение о потенциально положительных аспектах ирригации и хирургической обработки раны [16]. по сравнению с обменными операциями: снижение риска осложнений и кровопотери, сохранение костного материала и функции и снижение затрат. Тем не менее, показатели успеха этой процедуры санации раны низки и варьируются в литературе, в пределах от 15 % до 75 %, со средней скоростью эрадикации 44,9 % при среднем периоде наблюдения 52 месяца в недавнем систематическом обзоре, включая перипротезное колено. и инфекции тазобедренного сустава [17].
Если выполняются орошение и обработка раны, обязательно убедитесь, что протезы хорошо зафиксированы, не вызывают болезненных ощущений и находятся в правильном положении, а также имеется хорошая мягкая оболочка, покрывающая протез.
После орошения и обработки раны обычно следует период лечения антибиотиками, варьирующийся от 4 до 12 недель. Лечение антибиотиками должно проводиться системно и, по возможности, нацелено на изолированные патогены. Недостаточно доказательств, подтверждающих непрерывное внутрисуставное введение антибиотиков для лечения внутрисуставной инфекции, и в настоящее время это не рекомендуется [17].
Аналогичным образом, нет убедительных доказательств того, что использование любого местного рассасывающегося материала, пропитанного антибиотиками, значительно улучшает результат хирургического вмешательства по ирригации и санации раны, хотя их использование, по-видимому, не противопоказано [18].
Операция по обменной артропластике при инфекции, одно- или двухэтапная операция, является сложной процедурой и должна выполняться опытными центрами и хирургами. Нельзя игнорировать заболеваемость и смертность, связанные с такой операцией. Работа в команде имеет первостепенное значение для успеха операции. Необходим мультидисциплинарный подход с участием микробиологов, врачей-инфекционистов, анестезиологов-реаниматологов, пластических хирургов и хирургов-ортопедов с особым интересом к инфекциям [19].
Заключение
Перипротезная инфекция – серьезное осложнение, которое требует быстрого распознавания, точной диагностической оценки и адекватного лечения. Учитывая центральную роль, которую играют биопленки, и микробиологический, и хирургический подходы должны быть конкретно направлены на выявление бактерий, внедренных в биопленку, предотвращение прилипания бактерий к поверхности имплантата и удаление бактерий и биопленок, когда поверхность имплантата становится колонизированной микроорганизмами. К сожалению, наши знания о патогенезе инфекции ограничены, и, следовательно, большинство современных подходов к диагностике и лечению остаются неадекватными или лишь частично эффективными. Более того, у нас все еще отсутствует понимание роли хозяина и очень мало способов улучшить способность зараженного хозяина противостоять инфекциям, связанным с биопленками. Несмотря на эти ограничения, недавние новые технологии, более стандартизованные протоколы лечения и специализированные центры и бригады повысили общий уровень искоренения инфекции примерно до 80–90 % с приемлемым восстановлением функции в большинстве случаев [20]. На основании текущих исследований можно ожидать, что наша способность улучшать раннюю диагностику, предотвращать и лечить инфекции, связанные с имплантатами, улучшится в будущем, когда будут разработаны специально разработанные диагностические инструменты, антибактериальные покрытия имплантатов, и становятся доступными антибиотикопленочные агенты. Универсального алгоритма выбора подходящего клинического решения для данного пациента пока нет. Выбор лечения должен по-прежнему основываться на опыте каждой команды, непредвзятом подходе и откровенном обсуждении с пациентом возможных рисков и преимуществ различных вариантов в соответствии с конкретными условиями и потребностями.
Библиографическая ссылка
Казанлиева Ф.К., Безгодков Ю.А. ФАКТОРЫ РИСКА, ДИАГНОСТИКА, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ИНФИЦИРОВАНИЯ ПРИ ЭНДОПРОТЕЗИРОВАНИИ КРУПНЫХ СУСТАВОВ // Материалы МСНК "Студенческий научный форум 2025". 2021. № 8. С. 53-59;URL: https://publish2020.scienceforum.ru/ru/article/view?id=452 (дата обращения: 02.02.2026).

