БНЗТ – это разновидность лучевой терапии рака, которая заключается в избирательном уничтожении клеток злокачественных опухолей путём накопления в них стабильного изотопа бора-10 и последующего облучения тепловыми нейтронами. В результате захвата нейтрона бором-10 образуется литий-7 и альфа-частица. Альфа-частица обладает небольшой длиной свободного пробега, сравнимой с размером клетки, поэтому выделяющаяся энергия преимущественно воздействует на опухолевые ткани, не затрагивая здоровые окружающие ткани [1]. На сегодняшний день БНЗТ применяют для лечения глиобластом, рака головы и шеи как самостоятельно, так и вместе с химиотерапией (комбинированная терапия). В настоящее время в клинической практике применяют два борсодержащих препарата – это 4-дигидроксиборфенилаланин (BPA) и меркапто-клозо-додекаборат натрия (BSH), однако они не приводят к селективному накоплению бора в опухоли, поэтому разработка новых борсодержащих агентов является одной из важнейших задач для развития данного метода.
Современный подход к разработке агентов БНЗТ включает в себя сочетание в одной молекуле борсодержащего фрагмента с компонентом, нацеленным на опухоль (нуклеозиды, опухоль-специфические белки, наночастицы, липосомы и др). Кроме того, сейчас активно разрабатывается новый класс препаратов – тераностиков, которые, помимо терапевтического воздействия, обеспечивают визуализацию опухоли [2]. К современным тераностическим системам относятся конъюгаты лекарственных средств с красителями, которые поглощают свет в ближнем ИК-диапазоне [3].
Наш подход к разработке лекарственных средств предполагает объединение химиотерапевтического фрагмента и борного кластера в одной молекуле. В рамках данной работы нами был сконструирован и синтезирован агент B12H11TyrGC, включающий в себя борный кластер и химиотерапевтическое средство.
Химиотерапевтический нуклеозид гемцитабин, используемый нами для создания конъюгата, является одним из наиболее широко используемых препаратов в клинической онкологии [4]. В качестве носителя терапевтического агента был выбран человеческий сывороточный альбумин, меченный флуорофорным красителем. ЧСА биосовместим, обладает низкой токсичностью и содержит функциональные группы для конъюгации с низкомолекулярными соединениями. Для таргетной доставки в опухоль разработанное соединение содержит остаток малеимида, что позволяет ковалентно присоединить терапевтический агент к ЧСА путём тиол-енольной реакции в физиологических условиях.
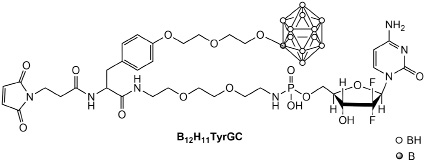
Дизайн разработанного соединения предусматривает программируемое высвобождение химиотерапевтического соединения в тканях опухоли за счёт кислотолабильной фосфамидной связи, гидролизующейся в лизосомах при попадании в клетку. Предполагается, что двойственная природа новых соединений позволит обеспечить комбинированное воздействие на клетки опухоли и повысит эффективность терапии. Строение целевого соединения и его предшественников подтверждено физико-химическими методами.

