В последние десятилетия, представление об амилоидозе существенно изменилось. Многочисленные исследования позволили создать несколько теорий, которые обосновали появление атипичного белка в тканях – амилоида, что помогало понять механизм развития отдельных форм амилоидоза, создать новую классификацию, обосновать дифференцированные подходы в морфологической диагностике и лечению. С помощью биомаркеров, биологических жидкостей и биопсийных тканевых компонентов. Расширились возможности ранней диагностики патоморфологического процесса. Усовершенствовались генетические, молекулярно-биологические методы диагностики, позволяющие рассматривать амилоидоз как мутационный процесс, особенно важный для обнаружения семейного типа амилоидоз. Большим шагом вперед являлось создание теорий патогенеза, объясняющих представления о происхождении данного заболевания. Цель работы заключалась в предоставлении рекомендаций с реализацией клинических установок в диагностике амилоидоза, подтверждённых микроскопическими данными гистологической визуализации для целостного представления ситуации. В статье обсуждается информативность биопсии и её диагностическая ценность, определен алгоритм гистологического, гистохимического, иммуногистохимического исследования материала с дифференциальным диагнозом обнаруживаемых патологических изменений. В обзоре проведен анализ молекулярно-биологических методов, используемых для верификации этиологии амилоидоза, даны современные морфологические критерии различных форм этого заболевания.
Проблема амилоидоза все еще далека от разрешения и продолжает привлекать внимание ученых. Это связано с разными причинами: достаточной распространенностью и особенно среди пожилых, трудностями диагностики и лечения, неблагоприятным прогнозом. По сути, амилоидоз не является отдельным заболеванием, а термином для описания заболеваний, которые имеют общую особенность как внеклеточное депонирование патологических нерастворимых фибриллярных белков в органах и тканях. В середине XIX столетия Вирхов заимствовал ботанический термин «амилоид», подразумевая крахмал или целлюлозу, для описания аномального внеклеточного вещества, обнаруженного в печени.
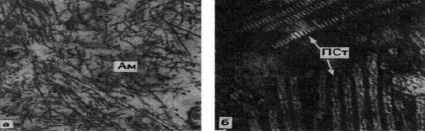
Рис. 1. Ультраструктура амилоида: а – фибриллы амилоида (Ам), х35 000; б – палочковидные образования (ПСт), х300000
Цель исследования. Предоставить рекомендации для реализации целевых клинических установок в диагностике амилоидоза органов сердечно-сосудистой системы с морфологических позиций гистолога для целостного представления поражения.
Материалы и методы. Объектом исследования являлись морфо-клинические показатели амилоидоза, данные о которых были получены на основе статейный материалов. Теоретическая ценность исследований определяется тем, что полученные результаты дают представление о патогенезе и диагностике с морфологической точки зрения при наиболее часто встречающихся типах AL-, ATTR-амилоидоза.
Результаты. В ходе исследования было показано, что амилоидоз – нарушение белкового обмена, которое сопровождается образованием и отложением в тканях специфического белково-полисахаридного комплекса – амилоида. Основным веществом в составе амилоида является F-компонент (рис. 1а) – фибриллярный белок, который образуется из α глобулина, активно синтезируемого амилоидобластами эквивалентные фибробластам. Небольшое количество белков плазмы крови в присутствии фибриллярного амилоидного белка самоорганизуется в палочковидные структуры, являющиеся P-компонентом амилоида, которые на электронограммах выглядят поперечно-исчерченными с чередованием чёрных и белых полос (рис. 1б). Другие белки плазмы крови остаются неструктурированными они называются – гематогенные добавки. Плотность амилоидному комплексу придают хондроитинсульфаты, синтез которых существенно усиливается фибробластами стромы под влиянием фибриллярного амилоидного белка. Р – компонент обладает антигенными свойствами и обеспечивает стабилизацию амилоидной структуры и препятствует её расщеплению вместе с гликозаминогликанами. Вступая в реакцию с хондроитисульфатами, даёт возможность присоединиться гематогенным добавкам. В образовавшемся комплексе образуются очень прочные связи, которые не подвергаются различным действиям ферментов человеческого организма.
Проблема возникновения аномального белка и накопления в его тканях привела к созданию теорий патогенеза. На сегодняшний момент их четыре, три из них существуют уже длительное время, а четвертая выдвинута недавно, в связи с изучением патогенеза амилоидоза на молекулярно-генетическом уровне. Согласно этой теории диспротеиноза возникает диспротеинемия, с накоплением в плазме крови грубодисперсных белковых фракций и аномальных белков – парапротеинов. Появляются они за счет нарушения белкового обмена с последующим возрастанием амилоидобластов. Затем они выходят за пределы сосудистого русла и соединяются с мукополисахаридами в тканях. Иммунологическая теория базируется на распаде тканей при различных заболеваниях и в крови начинают циркулировать токсины бактерий. Эти вещества обладают антигенными свойствами при этом вызывая на себя образование антител на фоне иммунной реакции при соединении антигенов с антителами в местах их продукции – органах ретикулоэндотелиальной системы. Теория клеточно-локального синтеза рассматривает амилоид как секрет мехенхимальных клеток. И наконец универсальная теория – мутационная. Мутагенные факторы влияют на клетки, вызывая мутации и запускается механизм, ведущий к формированию клеток амилоидобластов. Важную роль в диагностике амилоидоза играет количественное содержание плазматических клеток в красном костном мозге. При подозрении на AL-амилоидоз рекомендуют проводить биопсию прежде всего костного мозга. Выявление плазматизации костного мозга, более чем на 30 % констатирует существование у пациента AL-амилоидоза, в рамках множественной миеломы. Если к этому присоединяются важные диагностические признаки миеломы: возрастание парапротеина в крови и моче, лизис костей, анемия. Наиболее достоверным методом выявления амилоидоза является биопсия пораженных органов. Частота выявления амилоидоза в этом случае достигает 90-100 %. Достаточно информативной является биопсия слизистой оболочки прямой кишки, при которой вероятность выявления амилоидоза высока. При подозрении на первичный амилоидоз считают более предпочтительной аспирационную биопсию подкожной жировой клетчатки из передней брюшной стенки. С учетом широкого спектра биопсийного материала можно сделать вывод, о распространённости процесса, с диагностической вероятностью выявления амилоида акцентируя внимание, например, на слизистой оболочке десны. Особенностью амилоида при гистологическом исследовании микропрепаратов в световом микроскопе является то, что он очень похож на гиалин и выглядит как бесструктурный, гомогенный, плотный, стекловидный, розового цвета белок. Эндомиокардиальный биопсия часто дает информацию о поражении сердца амилоидом, когда биопсия других органов отрицательна или эхокардиография неспецифична [1].
Диагноз амилоидоза, предполагаемый по клиническим признакам, должен быть подтвержден морфологически при изучении биопсийного материала. В свою очередь, биопсия миокарда имеет почти 100 % чувствительность и допускает окончательное подтипирование амилоидоза [2].
Для выявления амилоидных масс в гистологических микропрепаратах применяют окраску щелочным Конго красным с дальнейшим изучением в поляризованном свете для выявления специфического отличительного свойства амилоида – способности к двойному лучепреломлению и в связи с этим можно наблюдать желто-зеленое свечение (рис. 2), (рис. 3В).
Отдельное внимание хочется уделить наследственному амилоидозу (ATTR), обусловленный отложением аномального белка транстиретина, являющегося переносчиком тироксина и комплекса ретинола [4].
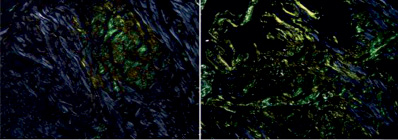
Рис. 2. Поляризованная микроскопия ткани миокарда [3]
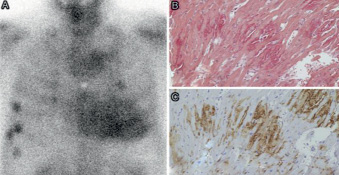
Рис. 3. Диагностики ATTR-амилоидоза. (А) Сцинтиграмма пирофосфата, меченного 99mTc, была положительной в сердце, что указывает на сосуществующий транстиретиновый сердечный амилоидоз. (B) Гистологические образцы биопсии миокарда, окрашенные Конго-красный. (C) Специфическая к транстиретину иммуногистохимия, показывающая неоднородные амилоидные отложения транстиретинового типа [5]
Для диагностики ATTR-амилоидоза могут использоваться сцинтиграфия, однофотонная эмиссионная томография с различными изотопами, которые позволяют неинвазивно с очень высокой специфичностью и достаточной чувствительностью поставить диагноз, но самое главное эта процедура позволяет избежать эндомиокардиальной биопсии (рис.3А). Наиболее точным методом определения ATTR-амилоидоза является иммуногистохимический анализ к транстиретину (рис.3С) [6].
Вывод. Предоставленный клинико-морфологический анализ исследований, на основе методологических примеров, позволяет интегративно раскрыть и обосновать скрытый, внутренний смысл функциональных нарушений, при амилоидозе.

