Был рассмотрен процесс ионообменной сорбции, применяемый во многих отраслях промышленности. Определили, какие вещества называются ионитами, и исследовали их состав. Выяснили, что ионит обуславливается такими параметрами, как ионообменная емкость и селективность. Познакомились с классификацией ионитов по происхождению (природе матрицы). По ней определили, что иониты подразделяются на органические и неорганические. Изучили свойства, обменную емкость, селективность и применение органических и неорганических ионитов.
Иониты – твердые нерастворимые высокомолекулярные вещества, способные вступать в реакции ионного обмена, диссоциации и адсорбции, благодаря наличию в них специальных (ионогенных) функциональных групп. Явление ионного обмена, широко распространенное в живой и неживой природе, успешно используется во всех областях науки и производства. Применение ионитов также перспективно для многих отраслей прикладной химии:
– основной неорганический синтез (производство серной, соляной, азотной кислот, едких щелочей и др.);
– производство катализаторов;
– производство фармацевтических препаратов.
Применение ионного обмена позволило осуществить непрерывные технологические процессы, а в ряде случаев их автоматизировать, проводить тонкие кинетические исследования с помощью катализа ионитами. Возрастает потребность в ионитах для ядерной энергетики. Атомные электростанции потребляют иониты для расщепляющегося топлива, обескислороживания, для очистки воды контуров ядерных реакторов и т.д. Это потребует большого количества ионитов, пригодных для использования в радиационно-химической технологии [1].
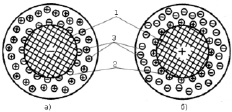
Ионообменная сорбция, или гетерогенный ионный обмен, представляет собой процесс взаимодействия раствора с твердой фазой, обладающей способностью обменивать ионы, содержащей в ней, на другие ионы, присутствующие в растворе. Вещества, составляющую твердую фазу представляются в виде ионитов. Иониты состоят из матрицы (каркаса, сшитого ковалентными связями) и функциональной группы. Матрица определяет нерастворимость в органических растворителях и может иметь как отрицательный, так и положительный заряд, определяющийся зарядом ионов функциональной группы, называемых потенциалообразующими (анкерными) ионами, и компенсирующийся противоположным зарядом подвижных ионов, называемых противоионами. Противоионы образуют диффузионный слой, они подвижны вокруг матрицы и могут быть заменены другими ионами с зарядом того же знака. В результате выделяют два типа ионитов: катиониты (нерастворимые кислоты) – иониты, способные поглощать положительные ионы – и аниониты (нерастворимые основания) – иониты, способные поглощать отрицательные ионы [2, 3].
2RNa + Са2+ + 2Cl- D R2Ca + 2Na+ + 2Cl- ROH + Na+ + Cl- DRCl + Na+ + OH-
Рис. 1. Структура элемента объема ионитов: а – катионит; б – анионит; 1 – матрица; 2 – потенциалообразующие фиксированные ионы; 3 – ионы диффузного слоя
Иониты обладают присущими обменной емкостью и селективностью. Ионообменная емкость – это количество ионов, зафиксированных в результате ионообмена единицей массы ионита в состоянии насыщения. Этот параметр определяется экспериментально путем обработки известной массы катионита (анионита) в его Н+-форме (OH--форме) избытком раствора, содержащего обмениваемый ион, после чего методом титрования устанавливается количество высвободившейся кислоты, если образец катионит, или щелочи, если анионит. Селективность ионитов понимают его различную способность фиксировать ионы в зависимости от их природы или, что то же самое, различное сродство ионов к иониту. Селективность ионитов зависит от многих факторов: от природы как ионов, так и ионитов, от заряда ионов, от кислотности раствора. В общем случае бóльшую способность к фиксации ионообменниками проявляют ионы, заряд и поляризуемость которых больше, а радиус гидратированного иона меньше [4]:
K+ < Ca2+ <Al3+ <Th4+
Ca2+<Be2+ = Mn2+<Mg2+<Zn2+<Cu2+ =
= Ni2+<Co2+<Ca2+<Sr2+<Pb2+<Ba2+
Существует несколько классификаций ионитов. Рассмотрим их классификацию по происхождению (природе матрицы). Иониты различаются на органические и неорганические. При этом они подразделяются на природные и синтетические. Природными органическими ионитами являются гуминовые кислоты углей, сульфоугли; синтетическими – ионообменные смолы. К природным неорганическим ионитам относятся алюмосиликаты (цеолиты, полевые шпаты, слюды, глинистые материалы, апатиты), а к синтетическим – силикагели, пермутиты, малорастворимые оксиды и гидроксиды алюминия, хрома, циркония [2].
Органические иониты занимают особое место среди многочисленных ионообменных материалов. Они более широко используются в промышленности, прежде всего для разделения и выделения органических веществ из смеси, например, лимонной, винной кислот и лизина. Органические иониты характеризуются наличием определенным анкерным ионом (единичной функциональной группы известного строения и состава), практически полной нерастворимостью. Также они обладают значительной гибкостью углеводородных связей каркаса при контакте с полярными растворителями, например, водой, что приводит к набуханию (увеличению объема).
Наиболее широкое применение нашли ионообменные смолы. Это синтетические полимеры, представленные в виде твердых шариков диаметром около миллиметра, центры которых содержат отрицательные или положительные ионы. В зависимости от заряда центра иониты подразделяют на 2 основных вида: катионообменная и анионообменная смолы. Так же существуют и другие виды ионообменных смол: амфотерные (в зависимости от условий выступают в качестве катионитов или анионитов), хелатные смолы (обладают исключительно высокой селективностью), окислительно-востановительные смолы (способны менять заряд ионов в среде). Ионообменные смолы – высокомолекуляные соединения кислого и основного характера, углеводородные радикалы которых образуют пространственную сетку с фиксированными ионногенными функциональными группами. Смолы получают в основном путем сополимеризации и стирола и дивинилбензола с добавлением тех или иных функциональных групп и выпускают в форме зерен (сульфирование, хлорирование, карбоксилирование).[6] Прочность зерен ионитов достаточно высока для многократного использования. Также проявляется их устойчивость в сильнокислой и сильнощелочной среде. Важнейшая характеристика ионообменных смол – это емкость обмена. Для сульфокатионитов она равна обычно 4–5 мг-экв/г, у средне- и слабоосновных (в том числе фосфорнокислых и карбоксильных) ионитов полная емкость весьма различна – от 2 до 11 мг-экв/г в щелочной среде. У сильноосновных анионитов емкость меняется от 2 до 5 мг-экв/г смолы.
Принцип работы ионита основан на ионном обмене, при котором целевые ионы обмениваются с ионами входящими в состав ионита, этот процесс происходит внутри шарика, в котором происходит замена второстепенного иона на целевой.
Рассмотрим селективность различных видов ионнообменных смол. Этот параметр связан с изменением энергии гидратации ионов и растет с увеличением степени сшивки (содержания дивинилбензола). У сульфокатионитов селективность растет: при увеличении радиуса негидратированного иона; при уменьшении радиуса гидратированного иона; при уменьшении энергии гидратации ионов; при уменьшении степени гидратации соответствующей моноформы ионита:
Li+ < H+ < Na+ < K+ < Rb+ < Cs+ < Ag+ < Tl+
Mg2+ < Ca2+ < Sr2+ < Ba2+ < Ra2+
Перенос из раствора в ионит более селективно сорбируемого иона сопровождается меньшей затратой энергии на его частичную дегидратацию и наибольшим выделением энергии при электростатическом взаимодействии с функциональной группой.
У карбоксильных катионитов селективность зависит от природы матрицы и положения карбоксильной группы по отношению к бензольному кольцу. У катионитов с матрицей из полистирола, в которых карбоксильная группа присоединена непосредственно к бензольному ядру, для однозарядных ионов характерен следующий ряд:
K+ < Cs+ < Na+ < Li+
Если же карбоксильные группы присоединены к бензольному ядру через метиленовую группу, то наблюдается ряд:
Cs+ < K+ < Na+ < Li+
А для ионитов с неароматической матрицей – ряд:
K+ < Na+ < Cs+ < Li+
Карбоксильные группы малы по сравнению с сульфогруппами, их силовое поле интенсивнее, что ведет к сильной дегидратации ионов в ионите, к более интенсивному электростатическому взаимодействию с дегидратированными ионами меньшего размера, компенсирующему затраты энергии на их дегидратацию.
У фосфорнокислых катионитов селективность связана с pH раствора. В слабокислых и нейтральных растворах, где диссоциирована только одна из групп ОН, наблюдается ряд:
Li+ < Na+ < NH4+ << K+ < Rb+ < Cs+ < Ba2+ ≈
≈ S r 2+ < Mg2+≈ Ca2+ < H+
Он отличается от ряда для сульфокислот особым положением иона H+ и более четким различием селективности двухзарядных и однозарядных ионов.
В условиях щелочной среды, где диссоциированы две группы ОН-, ряд существенно иной:
Cs+ < Rb+ < K+ < Na+ < Li+ < Ba2+ < Sr2+ < Mg2+ < Ca2+
Здесь ряд селективности схож с рядом избирательности карбоксильных смол.
Для сильноосновных анионитов ряд селективности имеет вид:
ОН-- < F-- < NH2CH2COO-- < CH3COO-- <
< HCOO-- < H2PO4-- < HCO3-- < Cl-- < NO2-- <
< HSO3-- < CN-- < Br-- < NO2-- < HSO4-- <
< I-- < цитрат-ион < салицилат-ион [7]
Неорганические иониты также используются во многих областях, в основном в ядерной теплоэнергетике и радиохимической промышленности. Области применения обусловлены их высокой термической и радиационной стойкостью. Также неорганические иониты используют для очистки расплавов от примесей (производство стекла), сточных вод от примесей, тяжелых металлов и радиоактивных веществ. В то же время способность неорганических ионитов сорбировать растворитель по сравнению с органическими ионитами мала, так как сорбция не сопровождается явлением набухания из-за жесткости каркаса. Однако для неорганических ионитов в большой степени, чем для органических, характерно наличие ситового эффекта, состоящей в различной доступности пространства ионитов из-за различной формы, размеров и заряда ионов, а так же особенностями полостей и каналов каркаса. Ионный обмен сопровождается образованием прочных соединений с полимерным каркасом, а также перестройкой кристаллической решетки. В связи с этим неорганические иониты проявляет большее многообразие в селективности, чем органические иониты [5].
Среди неорганических ионитов наиболее широко распространены цеолиты – группа кристаллических алюмосиликатов щелочных или щелочноземельных элементов с трехмерным каркасом. Каркас состоит из кремнекислородных [SiO4] и алюмокислородных тетраэдров, соединенных друг с другом общими вершинами, ребрами или плоскостями в многогранники, комбинации которых образуют ажурные структуры, имеющие полости и каналы, в которых расположены щелочные, щелочноземельные катионы и молекулы воды. Общий объём системы полостей и каналов цеолита составляет до 50 % объёма каркаса цеолита. Объединение тетраэдров в трехмерное тело через общие кислородные атомы могло бы создать электронейтральную решетку кристалла. Однако некоторая часть ионов кремния в тетраэдрах изоморфно замещена на ионы Al3+. B результате решетка цеолитов становится огромным трехмерным анионом – за счет избыточного заряда ионов кислорода. Ее заряд компенсируется зарядами располагающихся в полостях и каналах подвижных обменных катионов. Именно содержание алюминия в цеолитах определяет их определенную обменную емкость. Входные отверстия (окна) из каналов в полости цеолитов, образованные кольцами из атомов кислорода, – наиболее узкие места каналов. Их формой и размерами определяются величины ионов и молекул, которые могут проникнуть в полости. На этом основано применение цеолитов как молекулярных (и ионных) сит. Всего обнаружено шесть типов окон (кислородных колец), диаметр которых меняется от 1,6 до 8,0 Å (1 Å = 10-10 м, Å-анкстремы).
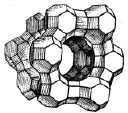
Рис. 2. Модель элемента ажурной кристаллической структуры цеолита Y
Интерес к ионному обмену на цеолитах прежде всего обусловлен существенным влиянием ионного состава на ситовые, сорбционные и каталитические свойства цеолитов. Из-за ограниченных размеров окон и полостей на цеолитах способны к обмену лишь относительно небольшие ионы. Обменная емкость, определяемая отношением Si/Al в структуре цеолита, наиболее высока для цеолитов А и X (5,5 и 4,7 мг-экв/г гидрати-рованного цеолита), у клиноптилолита (самого распространенного в природе цеолита) 2,2 мг-экв/г. Ряды селективности для цеолитов весьма сложны, и их характер, связанный с ситовым действием, трудно объяснить. Для цеолита А, содержащего в различных полостях шести- и восьмичленные окна, характерны ряды:
Li+ < Cs+ < Rb+ < NH4+< K+ < Na+ < Tl+ < Ag+;
Mg2+ < Hg2+ < Cd2+ < Ni2+ < Co2+ < Ca2+ <
< Ba2+ < Sr2+ < Zn2+
Для цеолита X характерен ряд
Li+ < Cs+ < Rb+ < K+ < Na+ < Tl+ < Ag+
при малых степенях обмена и ряд
Li+ < Na+ < K+ < Rb+ < Cs+ < Tl+ < Ag+
при больших степенях обмена. Для шабазита характерен ряд:
Li+ < Ca2+ < Sr2+ < Ba2+ ≈ Na+ < Pb2+ < NH4+<
< Rb+ < Ag+ < K+ < Cs+ < Tl+
Некоторые цеолиты (клиноптилолит) проявляют высокую селективность к иону цезия и используются в атомной промышленности, как поглотители радиоактивного 137Cs.
Хотя цеолиты используются в некоторых ионообменных процессах для разделения ионов, прежде всего в аналитической химии, основное их техническое значение обусловлено молекулярно-ситовой, каталитической и сорбционной способностями, модифицируемыми при замене одного иона на другой [7].
Таким образом, свойства органических и неорганических ионитов различны, и их применение определяется достижением той или иной цели.
Например, иониты применяют для очистка сточных вод. Использование природных цеолитов в очистке сточных вод является одной из наиболее перспективных областей их применения. Присутствие тяжелых металлов (Zn, Cr, Pb, Cd, Cu, Mn, Fe и др.) в сточных водах является серьезной экологической проблемой, и их удаление природными цеолитами широко изучалось наряду с другими технологиями, включая химическое осаждение, ионообмен, адсорбцию, мембранную фильтрацию, коагуляционную, флокуляцию, флотацию и электрохимические методы. Различные природные цеолиты по всему миру показали хорошую ионообменную способность катионов, таких как ионы аммония и тяжелых металлов. Модификация природных цеолитов может осуществляться несколькими методами, такими как кислотная обработка, ионный обмен и функционализация поверхностно-активных веществ. Модифицированные цеолиты могут проявлять высокую адсорбционную способность также для органических веществ и анионов.
Помимо использование для очистки воды иониты в виде ионообменной смолы применяют для извлечения редких металлов из растворов. Так, например, за счет адсорбционных свойств ионитов, используют ионообменные смолы для извлечения металлов платиновой группы из водных растворов, путем ионного обмена свободных ионов ионита и раствора, с дальнейшем восстановлением необходимых металлов платиновой группы. [8]

