Подагра – хроническое заболевание, обусловленное нарушением обмена пуриновых оснований.
Существует ряд причин, которые могут вызвать развитие данного заболевания. К таким этиологическим факторам относятся:
- усиленный синтез мочевой кислоты при одновременном снижении выведения её из организма (гликогеноз с недостаточностью фермента Г-6-ФДГ);
- торможение выведения мочевой кислоты (почечная недостаточность);
- увеличение катаболизма пуриновых нуклеотидов, что ведёт к избытку уратов (массивный апоптоз у пациентов с активированным аутоиммунным ответом);
- повышенное образование мочевой кислоты в организме (употребление в пищу большого количества мяса, рыбы, молока, шоколада).
Общие патофизиологические механизмы развития подагры
В основе развития подагры лежит такой процесс, как гиперурикемия – хроническое повышение уровня мочевой кислоты (UA) в крови для мужчин > 0,42 ммоль/л; для женщин > 0,35 ммоль/л. Увеличение концентрации UA в крови приводит к отложению солей мочевой кислоты преимущественно в тканях околосуставных областей и почках, что приводит к развитию воспалительных, а затем деструктивно-склеротических изменений в поражённых участках.
Новое в патогенезе подагры
Кристаллы урата мононатрия (MSU) способствуют привлечению макрофагов по принципу хемотаксиса, что приводит к развитию воспаления в местах отложения солей мочевой кислоты.
Развитие воспаления связано с активацией синтеза инфламмасомы (NLRP3) в макрофагах посредством MSU [1, с. 237, 2 с. 641]. Особенность взаимодействия MSU с макрофагами заключается в том, что поверхность урата мононатрия однородна и не несёт в себе отрицательных зарядов, которые способствуют фагоцитозу. Поэтому поглощение кристаллов происходит за счёт взаимодействия MSU с холестериновыми рецепторами на поверхности фагоцита, что и индуцирует эндоцитоз кристаллов [3, с. 1299].
NLRP3 – инфламмасома представляет собой высокомолекулярный мультимерный комплекс протеиновой природы [4, с. 87, 5, с. 2]. Инфламмасома активирует каспазу-1, а также продуцирует провоспалительные цитокины: интерлейкин-1β (IL-1β) и интерлейкин-18 (IL-18). Именно данные структуры являются пусковым фактором воспаления и инициируют некоторые формы клеточной гибели, одной из которых является пироптоз (от греч. “pyro” – огонь или лихорадка и “ptosis” – падение), также именуемый некоторыми авторами как «смерть в огне» [6, с. 1625].
Механизмы развития пироптоза при подагре
Пироптоз – запрограммированный тип клеточной гибели, активируемый провоспалительными каспазами. Каспазы – группа цистеиновых аспартат-специфичных протеолитических ферментов, пусковым фактором активации которых являются воспалительные агенты белковой и небелковой природы.
Механизм индукции пироптоза при подагре обусловлен цитоплазматическими Nod-подобными рецепторами (NLR или PRR (pattern-recognition receptors)), которые представляют собой внутриклеточные стимулы, способные формировать сигнал [7, с. 13, 8, с. 3]. Неактивированная молекула NLR имеет замкнутую конфигурацию за счет соединения данных структур. Взаимодействие с MSU является пусковым фактором активации NLR, что приводит к разрыву связей между концами молекулы. Благодаря подобным конформационным изменениям NLR включается в состав инфламмасомы. Таким образом, активная инфламмасома связывается с прокаспазой-1 с помощью собственного домена CARD (caspase activation and recruitment domain) или посредством CARD-домена адаптерного белка PYCARD. Несколько прокаспаз-1 распадаются на молекулы (р10 и р20), димеризуются, затем отщепляется CARD, в результате чего два гетеродимера соединяются, и происходит превращение прокаспазы-1 в активную форму. Образовавшаяся каспаза-1 инициирует образование IL-1β и IL-18 из молекул-предшественников, находящихся в инфламмасоме [9, с. 142, 10, с. 62].
Гасдермины (GSDM) – семейство белков, включающее несколько разновидностей в организме человека: GSDM-А; GSDM-В; GSDM-С; GSDM-D; GSDM-E и DFNВ59. Данные белки экспрессируются преимущественно в эпителиоцитах, участвуют в их пролиферации и дифференцировке [11, с. 675]. Благодаря связыванию с липидными структурами GSDM-N внедряется в бислой мембраны и вызывает олигомеризацию, результатом чего является формирование достаточно крупных пор диаметром 10-14 нм. При этом барьерная функция клетки нарушается, повышается проницаемость мембраны для осмотически-активных веществ и воды, что приводит к набуханию и лизису клетки (рисунок).
Интересно отметить, что существует еще один механизм формирования мембранных пор. Связывание кристаллов MSU с рецепторами на мембране макрофагов потенцирует формирование внутриклеточных сигналов активации сборки NLRP3, что сопровождается выходом калия через ионные каналы и высвобождением активных форм кислорода (АФК). АФК воздействует на структурный компонент митохондриальной мембраны – кардиолипин, который участвует в регуляции ферментов энергетического метаболизма. Окисление кардиолипина АФК в гидроперекись вызывает его транслокацию с внутренней мембраны на внешнюю и, как следствие, формирование пор. Данный белок способен инициировать сборку инфламмасомы NLRР3 (NACHTLRR-PYD-containing protein-3) [12, с. 195].
Среди молекул, участвующих в механизмах иммуновоспалительного ответа, можно выделить две группы: РАМРs (pathogen-associated molecular patterns) и DАМРs (damage-associated molecular patterns). К первым относятся патогенетически-ассоциированные молекулярные структуры преимущественно экзогенной природы.
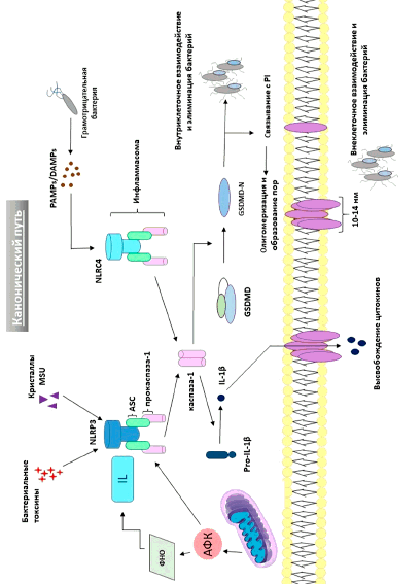
Каспазозависимая активация пироптоза
Например, липополисахариды клеточной стенки бактерий или генетический материал вирусов (ДНК или РНК). В то время как к DАМРs относятся такие эндогенные факторы, как АТФ, мочевая кислота, цитокины, деградированная митохондриальная ДНК, а также АФК [13, с. 99]. Стоит отметить, что данные молекулы способны активировать сборку инфламмасом и инициировать запуск программируемой клеточной гибели по типу пироптоза.
Таким образом, образование NLRP3 состоит из двух этапов:
1) сборка компонентов инфламмасомы (белка NLRP3, адапторной молекулы ASC и каспазы-1;
2) организация инфламмасомы.
Помимо MSU в синтезе инфламмасом может принимать участие растворимая мочевая кислота (SUA). После поглощения макрофагами SUA может образовывать микрокристаллы мочевой кислоты внутри клетки, тем самым индуцировать синтез NLRP3.
Также известно, что SUA может активировать IL-1β и IL-18 без участия инфламмасом, путём метилирования провоспалительных цитокинов [14, с. 757].
Основываясь на полученных теоретических знаниях, можно сделать вывод о том, что в лечении подагры довольно эффективным будет применение следующих групп препаратов:
1) Ингибиторов сборки NLRP3 инфламмасомы:
Морин (3,5,7,2’,4’-пентагидроксифлавон), содержащийся в экстракте дерева Morus tinctoria L. (красильное тутовое дерево). Представляет собой флавонол, который ингибирует синтез NLRP3 опосредованный взаимодействием MSU с холестериновыми рецепторами на поверхности макрофага. Ингибиторы ксантиноксидазы, которые оказывают прямое действие на синтез АФК, а также обладают свойством ингибировать MSU-индуцированную активацию инфламмасомы [15, с. 5].
2) Ингибиторы активации провоспалительных цитокинов – IL-1β и IL-18. К таким препаратам можно отнести канакинумаб, который являясь антителом, специфически блокирует рецепторы к IL-1β, тем самым предотвращая его воспалительный эффект. Анакинра – вещество, механизм действия которого заключается в ингибировании связывания IL-1α и IL-1β с IL-1R1 [16, с. 159].
3) Ингибиторы ключевого фермента в активации инфламассомы – каспазы-1. Данная группа препаратов считается более эффективной по сравнению с ингибиторами активации IL-1β ввиду того, что вещества ингибирующие каспазу-1 действуют на более раннем этапе в цепочке образования провоспалительных цитокинов. К таким препаратам относится «селективный ингибитор каспазы-1 VX-765», блокирующий переход прокаспазы-1 в активную форму [17, с. 112]. Однако, на данный момент не проводилось клинических испытаний подобного рода.

